オフラベル使用の質問チェックリスト
医師は、学術誌掲載の臨床研究、NCCNガイドライン、他の医師の症例報告の3つの根拠を重視しています。たとえ科学的根拠が不十分(78%が不足)でも、患者の命を守るために判断しています。
NCCNガイドラインは保険適用の基準です。学術雑誌の論文や症例報告も重要ですが、78%のオフラベル使用は十分な科学的根拠がありません。保険会社は「NCCNに載っているか」で支払いを決めるため、この質問は重要です。
保険適用には「FDA承認用途と類似」「学術雑誌掲載」「NCCNガイドライン」の3条件を満たす必要があります。満たせないと全額自己負担で、平均3~5日間の事前承認手続きが必要です。副作用リスクも医師が説明する必要があります。
オフラベル使用は「知恵」と「リスク」の両面があります。他の治療法や薬を確認し、最適な選択をします。医師が「この薬が最も適切です」と説明できるか確認してください。
あなたの医師が処方した薬が、実は「承認されていない用途」で使われている――そんなことは、意外とよくあります。がんの治療に使われる薬が、関節リウマチの治療にも使われたり、小児の発作を抑えるために成人用の薬が使われたり。これは「オフラベル使用」と呼ばれる、医療現場で当たり前のように行われている実態です。
オフラベル使用とは何か
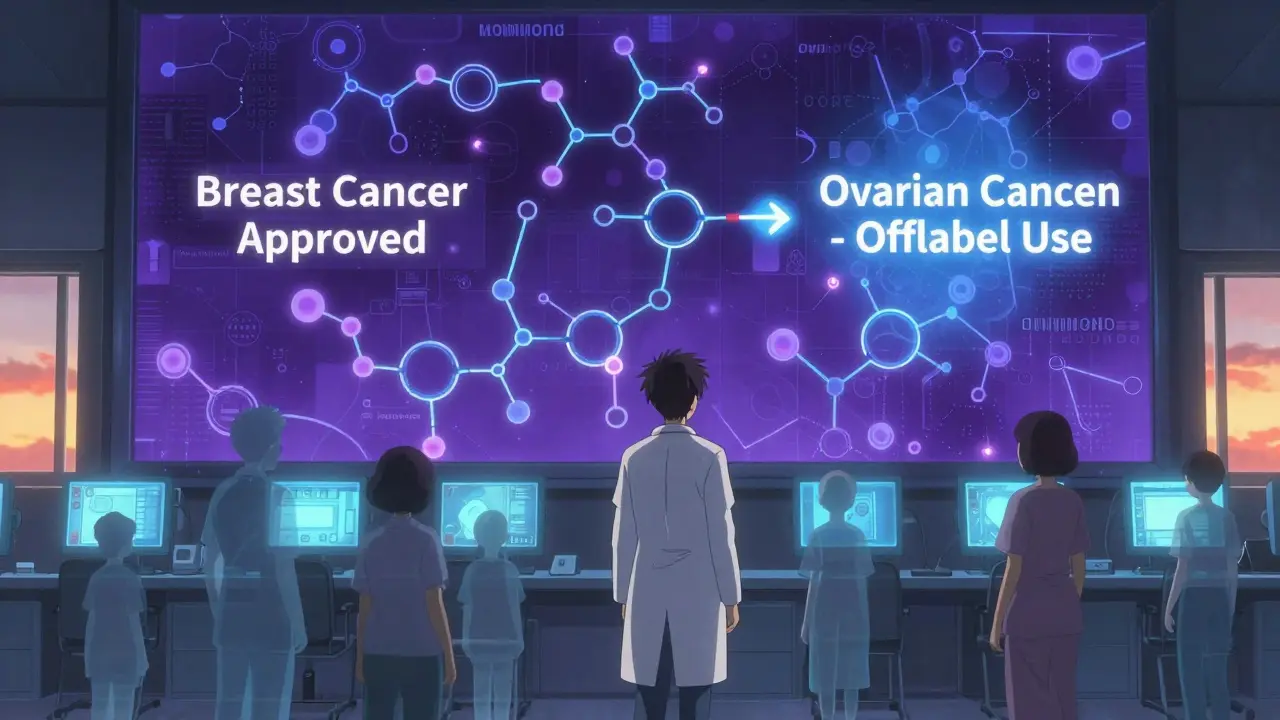
オフラベル使用とは、薬が米国食品医薬品局(FDA)や欧州医薬品庁(EMA)などの機関によって「特定の病気や年齢、投与方法」に承認されている以外の用途で使われることを指します。たとえば、ある薬が「乳がんの治療」にしか承認されていなくても、医師が「卵巣がん」に効果があると判断して処方すれば、それはオフラベル使用です。投与量を増やしたり、飲み薬を注射に変えたり、子供に成人用の薬を処方するのも、すべてオフラベルです。
このやり方は、1962年の米国連邦法改正で明確に合法化されました。FDAは「薬を安全で効果的であると認める」ことまではできますが、医師がどう処方するかまで規制することはできません。つまり、薬の「販売」はFDAが管理しますが、「処方」は医師の判断に委ねられているのです。
なぜこんなに多くの薬が承認外で使われるのか
理由はシンプルです:承認されている薬が、足りないからです。
小児科では、使われている薬の約62%がオフラベルです。なぜなら、薬の臨床試験は大人を対象にすることがほとんど。子供の体重や代謝、副作用の反応は大人とは違うのに、製薬会社は「子供用の試験」をしないのが普通。結果、医師は「この薬は大人では効くから、子供にも試してみよう」と判断するしかありません。
がん治療でも同様です。がんの種類は数百通りあり、新しいタイプのがんが次々と見つかる一方で、新薬の開発は遅い。そこで、あるがんに承認された薬が、別のがんの分子標的にも反応する可能性を医師が見抜き、オフラベルで使うのです。実際、がん治療薬の85%はオフラベルで使われているとされています。
精神科でも、抗精神病薬の31%が「うつ病」「不眠」「不安障害」など、本来の承認用途以外に使われています。これらの薬は、脳内の神経伝達物質に作用するため、他の病気にも応用できるのです。
メリットとリスク:両面の現実
オフラベル使用の最大のメリットは、「救える命がある」ことです。
たとえば、静脈注射の免疫グロブリンは、本来「免疫不全症」にしか承認されていません。しかし、ある稀な自己免疫疾患の患者が、他のすべての治療が失敗した後、この薬で命を救われたケースが米国で報告されています。その患者は、保険の承認を得るために3ヶ月も書類をやりとりしました。
一方で、リスクも無視できません。
1990年代、ダイエット薬「フェンフルラミン」と「フェンテルミン」の組み合わせが、心臓弁膜症を引き起こし、数千人が重い後遺症を抱えました。この薬は「ダイエット」に使われていたのですが、その用途は承認されておらず、安全性のデータも不足していました。結果、両薬は市場から撤退しました。
最近では、糖尿病薬のセマグリュチド(オゼンピック)が、体重減少目的で急増しています。2020年から2023年の間に、このオフラベル使用は3倍に増えました。しかし、長期間の安全性データはまだ不十分。糖尿病患者以外の人が使うと、膵臓炎や腸閉塞のリスクが高まる可能性があります。
医師はどのように判断しているのか
医師がオフラベル処方を決めるとき、単なる「試してみよう」ではありません。彼らは、次の3つの根拠を重視します:
- 学術誌に掲載された臨床研究(特にランダム化比較試験)
- 米国がん治療学会(NCCN)やDRUGDEXのような専門機関のガイドライン
- 他の医師の実績や症例報告
特にNCCNのガイドラインは、米国の医療保険がオフラベル使用をカバーするかどうかの「基準」になっています。保険会社は「NCCNに載っているなら、保険で支払う」と明言しています。
しかし、実際には、78%のオフラベル使用が「十分な科学的根拠」を持っていないという研究もあります。つまり、医師の経験や「なんとなく効きそう」という感覚で処方されているケースも、少なくないのです。
保険とお金の問題
オフラベル使用の最大の壁は、「保険が下りない」ことです。
UnitedHealthcareなどの保険会社は、オフラベル処方を保険適用にするために、以下の条件を満たすように求めます:
- FDAの承認された用途と類似していること
- 学術雑誌に掲載されていること
- NCCNやDRUGDEXに記載されていること
この条件を満たさないと、患者は全額自己負担になります。ある医師の調査では、オフラベル処方のために保険の事前承認を取るのに、平均3~5日かかり、その間に治療が遅れるケースが45%あると報告されています。
また、医師は「責任問題」にも敏感です。処方した薬で重い副作用が出たとき、保険がカバーしない場合、医師が訴えられるリスクが高まります。そのため、多くの医師は「この薬はオフラベルで、リスクはこれです」と、患者に説明し、署名を取るまでに30分以上かけることもあります。

製薬会社の禁じられた行動
オフラベル使用は医師には許されていますが、製薬会社には厳しく禁じられています。
製薬会社が「この薬は、うつ病にも効きますよ」と宣伝したり、医師に「この使い方を推奨します」と資料を配ったりすれば、違法です。2012年、グランクスミスクラインは、抗精神病薬のオフラベル宣伝で30億ドルの罰金を支払いました。2009年以降、製薬会社はオフラベル宣伝で合計140億ドル以上の罰金を科されています。
なぜこんなに厳しいのか? それは、製薬会社が「利益」を追求するからです。薬の新しい用途を正式に承認してもらうには、5~7年、5000万~1億ドルの費用がかかります。それなら、すでに売れている薬を、医師に勝手に使ってもらったほうが、コストが圧倒的に安い。でも、宣伝はできない。だから、医師が自発的に使うように仕向ける「間接的な方法」が、闇の中で行われてきたのです。
未来はどうなる?
2023年、FDAは「リアルワールド・データ」(電子カルテや患者登録データ)を使って、オフラベル使用の効果を正式に評価する仕組みを強化し始めました。つまり、今、医師が「試している」オフラベル使用の多くが、将来的に「正式な承認用途」になる可能性があります。
たとえば、セマグリュチドは、今、体重減少目的でオフラベル使用されていますが、FDAはすでに「肥満治療薬」としての正式承認を申請しています。数年後には、この薬のオフラベル使用は、ほとんどなくなるかもしれません。
一方で、希少疾患やがんの分野では、新しい治療法が次々と生まれるため、オフラベル使用は今後も必要不可欠です。FDAの委員長は2023年にこう語っています。「オフラベル使用は医療の一部であり、これからも必要です。でも、それを科学的に裏付ける仕組みを、もっと速く、もっとしっかり作らなければなりません。」
患者が知っておくべきこと
もし医師から「この薬は、実はこの病気に承認されていないんです」と言われたら、どう対応すべきでしょうか?
- 「なぜこの薬を選んだの?」と質問する
- 「どの研究やガイドラインが根拠になっているの?」と聞く
- 「副作用のリスクは? 保険は使える?」と確認する
- 「他の選択肢は?」と尋ねる
オフラベル使用は、医療の「知恵」でもあり、「リスク」でもあります。それは、医師の判断が、患者の命を左右するという、医療の本質そのものです。
あなたが処方された薬がオフラベルかどうか、知らなくてもいい。でも、もし疑問に思ったら、尋ねてください。あなたの命を守るのは、医師の知識だけではありません。あなた自身の問いかけが、正しい選択を生み出します。